您现在的位置:中考成都站 > 中考备考 > 中考复习 > 中考化学 > 正文
来源:本站原创 2011-09-22 11:36:49

成都中考网10月8日 中学化学中常见酸的特性
1、不稳定性酸
这部分酸包括H2CO3、H2SO3、HCIO、HNO3(浓)、H4SiO4、氢硫酸(H2S)、氢碘酸(HI)、氢硒酸(H2Se)、氢碲酸(H2Te)等。
(1)常温(或微热)易分解的酸:H2CO3、H2SO3、HNO3(浓)、H4SiO4等。
(2)见光易分解的酸:HCIO、HNO3(浓)。
(3)易被氧气氧化而变质的酸:H2S、HI、H2SO3、H2Se、H2Te等。
2、强氧化性酸
这部分酸包括浓HNO3、稀HNO3、浓H2SO4、HCIO等,它们的强氧化性主要表现在以下几个方面。
(1)常温下,浓H2SO4、浓HNO3能使Fe、AI等金属发生钝化。
(1)
能氧化大多数的金属单质(Au、Pt除外)。
(3)能氧化部分非金属单质(如S、C、P、I2等)。
3、强还原性酸
这部分酸包括H2S、HI、H2SO3、H2Se、H2Te、H3PO3、HBr、H3ASO3等。
4、易挥发的酸
这部分酸包括HF、HCI、HBr、HI、浓HNO3等。
5、高沸点、难挥发性酸
这部分酸包括浓H2SO4、浓H3PO4等。
6、具有漂白性的酸
这部分酸包括HCIO、H2SO3等。
7、具有强吸水性的酸
这种酸是浓H2SO4,浓H2SO4可作气体干燥剂。
8、具有脱水性的酸
这部分酸包括浓H2SO4、浓H3PO4。
9、能腐蚀玻璃的酸
这种酸是氢氟酸(HF)。
10、有剧毒的酸
这部分酸包括HF、HPO3(偏磷酸)、HCN。
11、能溶解铂、金的酸
这种酸是王水(浓硝酸和浓盐酸组成的混合物)。
12、不溶于水的酸
这部分酸包括H2SiO3、H4SiO4,硬脂酸、软脂酸、油酸。
13、能与酸发生反应的酸
这部分酸包括H2S、HI、HBr、氨基酸等,H2S、HI、HBr遇强氧化性酸能发生氧化还原反应,氨基酸中存在碱性基团氨基(-NH2)。
14、遇氨气能冒白烟的酸
这部分酸包括浓盐酸、浓硝酸、醋酸等,即它们挥发出来的酸与氨气反应生成相应的铵盐(固体)的缘故。
15、可用于制造炸药的酸
硝酸可用于制取硝化甘油、三硝基甲苯(TNT)、硝酸纤维等烈性炸药。
16、能发生显色反应的酸
浓HNO3遇含苯环的蛋白质会显黄色;苯酚与FeCI3溶液反应生成紫色的物质。
17、能发生银镜反应的酸
甲酸(HCOOH)能发生银镜反应。
18、能发生酯化反应的酸
无机含氧酸和有机羧酸。
19、与苯环能发生取代反应的酸
浓HNO3、浓H2SO4可发生此类反应。
20、能作催化剂的酸
浓、稀H2SO4、H3PO4、浓盐酸等,例如浓H2SO4可作硝化反应、酯化反应、水解反应等的催化剂,磷酸是乙烯水化法的催化剂,浓盐酸是制取酚醛树脂的催化剂等。
一、酸、碱、盐的组成
酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
二、酸
1、浓盐酸、浓硫酸的物理性质、特性、用途

2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属+酸→盐+氢气
(3)碱性氧化物+酸→盐+水
(4)碱+酸→盐+水
(5)盐+酸→另一种盐+另一种酸(产物符合复分解条件)
3、三种离子的检验
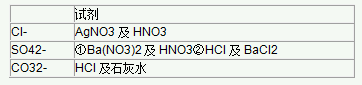
三、碱
1、氢氧化钠、氢氧化钙的物理性质、用途

2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱→盐+水
(3)酸+碱→盐+水
(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2ΔCuO+H2O
2Fe(OH)3ΔFe2O3+3H2O
②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓Fe(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
四、中和反应溶液酸碱度的表示法--pH
1、定义:酸与碱作用生成盐和水的反应
2、应用:
(1)改变土壤的酸碱性
(2)处理工厂的废水
(3)用于医药
3、溶液酸碱度的表示法--pH
(1)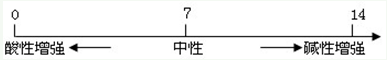
(2)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH<5.6的雨水为酸雨
五、酸性氧化物与碱性氧化物
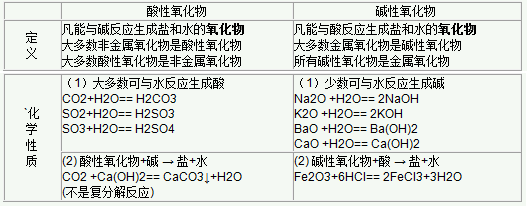
2023中考一路陪伴同行,百万名校真题直接下载!>>点击查看